電池
電池(cell)という言葉は日常的に使いますが「化学反応の際に放出される化学エネルギーを電気エネルギーに変換する装置」を特に化学電池(chemical cell,electrochemical cell)と呼んでいます。電池は起電力(electromotive force, emf)を持ちますが,化学熱力学 > 酸化還元で説明したように,開回路の電極間電位差である電池電位(cell potential)により起電力を表すことができます。
電極
電池や電気分解の電極をどう呼ぶかについて,正極・負極および陽極・陰極という用語の使い分けがややこしいという印象を持っている方もいると思います。実はそう思うのが正解で,専門家の間でもややこしいという理由で別の呼び方が推奨されているのですが,それについては後で述べるとして,まずは高校化学の復習をします。初めに正極と負極ですが,これは電池の電極を表す用語で高校化学の教科書では次のような説明がされています。
導線に向かって電子が流れ出る電極が負極であり,導線から電子が流れ込む電極が正極である。
この定義に基づくと,化学電池の負極では酸化反応,正極では還元反応が起こります。そして次に陽極と陰極ですが,これは電気分解で用いる用語です。高校化学の教科書では以下のように説明されます。
電源の正極につないだ電極が陽極であり,電源の負極につないだ電極が陰極である。
電源の正極は上の定義により導線から電子が入ってくる電極ですから,そこにつながれている陽極では電子が奪われる酸化反応が起こります。反対に負極は電子が流れ出る電極ですので,そこにつながる陰極では還元反応が起こります。ここまでが高校化学で習った電極の定義の復習です。まとめると次にようになります。
- 電極と酸化還元の対応
正極では還元反応が起こり,負極では酸化反応が起こる。
陽極では酸化反応が起こり,陰極では還元反応が起こる。
しかし,これから先の頭の混乱を避けるためこの話は一度忘れ,頭をまっさらにして以下の説明を読んでください。
電極に名前を付けるとき,二つの判断基準があります。一つはそこで酸化が起こるのか還元が起こるのかの違いで判断する方法,そしてもう一つは電位の高低の違いで判断する方法です。正極・負極と言う用語は(高校での説明は忘れて)それぞれ電位の高い側と低い側を表す用語であると理解してください。電流は電位の高い側から低い側に向かって流れますので,電池の放電では負極で酸化反応,正極で還元反応が起こり,電位を基準にした定義を採用したとしても,結果として高校の教科書の説明は間違っていません。
次に二次電池の充電を考えてみましょう。充電では充電器の正極(電位が高い)を電池の正極,そして充電器の負極(電位が低い)を電池の負極につなぎます。したがって電位の高低関係は電池の放電と充電で変わりませんが,電流が逆向きになるので,充電時は電池の正極で酸化,負極で還元が起こることになり,高校の教科書の定義だと矛盾してしまいます。
そこで充電(電気分解)のときに使う用語として用意されたのが陽極・陰極で,これらは酸化・還元を判断基準とする用語です。用語を使い分けることで,同じ電池であっても用語によって放電の話をしているのか充電の話をしているのかが明確になりますし,高校の教科書にある説明とも矛盾しません。これで解決と言いたいところですが,話はそれで収まらず,実は陽極・陰極を電位の高低で呼び分ける流儀が存在しており混乱を招いています。
そこで現在の流れとしては,この混乱を避けるため,陽極・陰極という用語を使うのは避けて,電池であろうと充電や電気分解であろうと電気化学的に還元が起こる電極をカソード(cathode),酸化が起こる電極をアノード(anode)と呼びましょうと推奨されています。電池と電気分解で正極・陽極と呼びわける必要もなくなりますので,今後はカソード・アノードを使うことを推奨します。かんげん,カソードと覚えましょう。
ただし,電池に関しては乾電池を使うときなどでも正極(プラス極)と負極(マイナス極)という言葉はもう一般化していて,電位の高い側・低い側という意味で定着していますし,化学電池ではない一般の電源では酸化還元反応は起こりません。したがって電池の放電では電位の高い低いの区別として正極・負極という用語も使われます。まとめると次のようになります。
電池・電気分解にかかわらず,還元が起こる側をカソード,酸化が起こる側をアノードと呼ぶ。ただし,そうすると電池の充放電でカソードとアノードが入れ替わってしまうので,その紛らわしさを避けたいのであれば,電池の放電時に限っては電位が高い側を正極,低い側を負極と呼んでも良い。
ダニエル電池
古典的な化学電池の代表格であるダニエル電池は,1836 年にイギリスの John Frederic Daniell によって発明されました。ダニエル電池の模式図を二通り以下に示します。
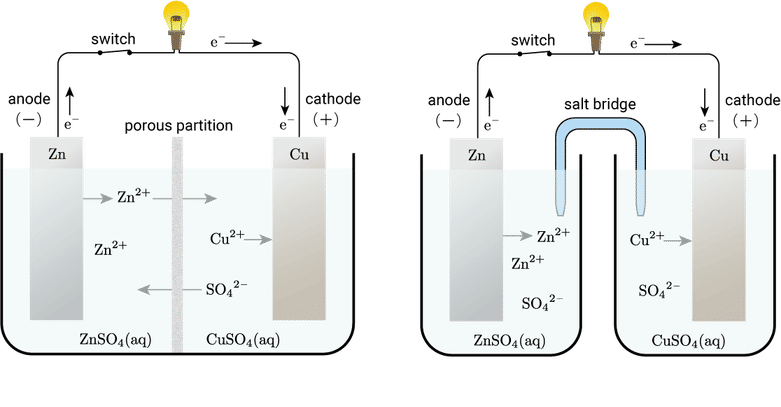
ダニエル電池
高校化学の教科書でなじみがあるのは左のタイプだと思います。硫酸亜鉛 $\ce{ZnSO4}$ 水溶液に亜鉛板を浸した図の左側部分(負極室)と硫酸銅 $\ce{CuSO4}$ 水溶液に銅板を浸した右側部分(正極室)が素焼き板(porous partition)で仕切られています。素焼き板は左右の溶液が混ざらないようにする役割がありますがイオンは通すことができます。負極室の電極は亜鉛の酸化が起こるからアノード,正極室の電極は銅イオンの還元が起こるからカソードです。これを電池式(または電池図)と呼ばれる記法で表記すると次式となります。
縦棒 $|$ は界面や液相間の境界を表し,例えば $\ce{Zn|ZnSO4(aq)}$ は亜鉛板と硫酸亜鉛水溶液が接していることを意味します。中央の縦棒は素焼き板のことでが,素焼き板の縦棒は点線や破線の縦棒にする場合もあります。通常左側に負極,右側に正極を書き,それぞれ $(-)$ と $(+)$ でそのことを表します。
次に上の図の右側を見てみましょう。先ほどとの違いは素焼き板がなくなり,負極室と正極室が完全に分離しています。その代わり,負極室と正極室を結ぶ新たな要素である塩橋(salt bridge)というものが登場しています。塩橋とは何者で,図の左のタイプと右のタイプでは何が違うのでしょうか。負極室では反応が進むにつれてカチオンが増え,正極室ではカチオンが減ります。そのため亜鉛イオン $\ce{Zn^{2+}}$ と硫酸イオン $\ce{SO4^{2-}}$ がそれぞれ素焼き板を通過して反対側に移動することで溶液内の電荷バランスが保たれるのですが,実はイオンの種類ごとに動きやすさが異なるため,電池を使い続けて反応が継続していると,溶液内の電荷のバランスが崩れて,負極室の溶液と正極室の溶液との間に液間電位差(liquid junction potential)と呼ばれる電極間の電位差とは別の電位差が生じます。塩橋は液間電位差が生じるのをできるだけ抑える目的で用いるものです。塩橋の成分はカチオンとアニオンの移動速度が近いイオンの組み合わせからなるものを使うのが一般的で,塩化カリウム $\ce{KCl}$ や硝酸アンモニウム $\ce{NH4NO3}$ を寒天などで固めたものがよく用いられます。塩橋を用いたダニエル電池の電池式は以下のように書きます。塩橋は二重線 $||$ で表しますが,塩橋の成分を明示したいときは式\eqref{daniell_lKCll}のように書く場合もあります。
起電力
電池は起電力をもち,起電力は電池電位で表されます。しかし電池電位は二つの電極電位の差で表されますので,どちらからどちらを引くのかについての任意性が残ります。例えばダニエル電池の起電力は約 $1.1\unit{V}$ ですが,これを $-1.1\unit{V}$ としても良いはずです。この点については 1953 年の IUPAC 総会でルールが定められており,この会議がストックホルムで開かれたことからストックホルム規約と呼ばれています。既に「半反応式は還元反応で記述するのが一般的」と述べていますが,これもストックホルム規約で定められたものです。また,ストックホルム規約によると起電力は次のように定められます。
電池式の左側の電極を基準としたときの右側の電極の電位をその電池の起電力とする。
つまり電池式の右側の電極電位から左側の電極電位を引けば起電力になります。これはすなわち右側で還元反応,左側で酸化反応が自発的に進む条件のときに起電力が正になることを意味します。この基準によればダニエル電池の電池式を $\ce{Zn|ZnSO4(aq)|CuSO4(aq)|Cu}$ と書けば $\Eocell = 1.1\unit{V}$ となりますし,反対に $\ce{Cu|CuSO4(aq)|ZnSO4(aq)|Zn}$ と書けば $\Eocell = -1.1\unit{V}$ となります。ただし後者の場合は $\DGo{r} > 0$ となって,$\ce{Cu}$ が $\ce{Cu^{2+}}$ に酸化されて $\ce{Zn^{2+}}$ が $\ce{Zn}$ に還元される反応は自発的には進みません。進まない反応の電池式をかいても仕方ない(電池にならない)ので,電池式は電池電位が正になるように書き,このとき右側が正極,左側が負極になります。このことから既に述べた通り,ダニエル電池の電池式は以下のように書くのが一般的です。
既に紹介した標準水素電極 SHE を用いた標準電極電位の測定もこのルールに則っています。つまり電池式の左側に SHE,右側に調べたい電極を書くと,調べたい電極の標準電極電位はストックホルム規約に則ったこの電池の起電力となります。

