田辺・菅野ダイヤグラム2
$\ao{d}^4$ 電子配置
前節で $\ao{d}^2$,$\ao{d}^3$ 電子配置の田辺・菅野ダイヤグラムを見ました。ここでは $\ao{d}^4$ 電子配置の場合について確認します。
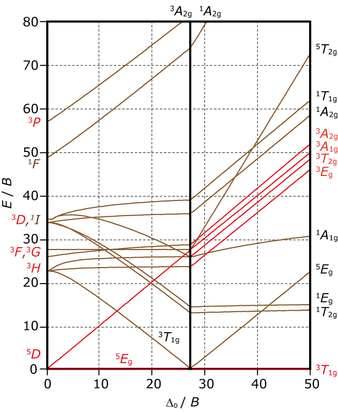
$\ao{d}^4$ 電子配置の田辺・菅野ダイヤグラム
$\ao{d}^2$,$\ao{d}^3$ の場合と比べたときの最も大きな違いは図の中央部分付近に縦線が引かれていて,それを境にエネルギー準位を表す曲線がカクッと切り替わっているところです。これはこのタイミングで錯体が高スピン HS から低スピン LS に切り替わることを示しています。実際,基底状態であるエネルギーゼロのラインを見てみると,図の左側(HS)では $\irrep{^5E}{g}$ と書かれ,五重項であることが分かりますが,切り替え線を境に $\irrep{^3T}{1g}$ と三重項に変わっています。
前節では $\ao{d}^3$ の $\ce{Cr^{III}}$ アクア錯体のスペクトルにおいて,田辺・菅野ダイヤグラムが予測する通り 3 本の吸収帯(うち一つは一部のみ)が観測されました。では,クロムの酸化数を 1 小さくした,$\ce{Cr^{II}}$ アクア錯体のスペクトル形状はどのように予測されるでしょうか。アクア錯体は一般に HS 状態をとりますので,$\ao{d}^4$ HS の田辺・菅野ダイヤグラムを確認すると,スピン多重度が基底状態と等しいスピン五重項の励起状態は一つしかなく,観測される吸収帯は一つであると予測できます。下図は $\ce{[Cr^{II}(OH2)6]^{2+}}$ の吸収スペクトルです。田辺・菅野ダイヤグラムが予測する通り,吸収スペクトルには吸収帯は一つしか観測されていません。
![[Cr(II)(OH2)6]2+の吸収スペクトル](https://ik.imagekit.io/tfukuda/tr:w-0.5/coordchem/abs_Cr_II__OH2_6_loqc0gTy5.png?ik-sdk-version=javascript-1.4.3&updatedAt=1656943313888)
$\ce{[Cr^{II}(OH2)6]^{2+}}$ の吸収スペクトル
同じ金属,同じ配位子であっても,観測される吸収帯にこれだけ大きな違いが生じます。その違いを適切に予測することができる田辺・菅野ダイヤグラムの威力を感じることができる一例ではないでしょうか。
$\ao{d}^5$ 電子配置
$\ao{d}^5$ 電子配置の田辺・菅野ダイヤグラムを確認します。
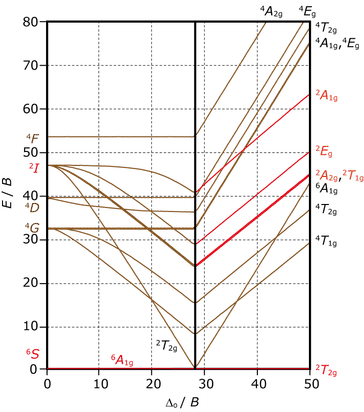
$\ao{d}^5$ 電子配置の田辺・菅野ダイヤグラム
高スピンの基底状態は $\term{6}{S}{}$ で,励起状態にスピン六重項がないため,$\ao{d}$-$\ao{d}$ 遷移はすべてスピン禁制となり,吸収強度が著しく弱くなります。この典型例が $\ce{Mn^{2+}}$ イオンで,水溶液中でアクア錯体として存在し,淡赤色のほとんど見えないといってもよいくらいの薄い呈色を示すことは高校の化学で習った方もいると思います。下図は $\ce{[Mn(OH2)6]^{2+}}$ の吸収スペクトルです。縦軸のモル吸光係数 $\varepsilon$ が極めて小さいので,吸収帯がたくさんありますが,可視光の吸収はほとんど起こりません。田辺・菅野ダイヤグラムから予測される励起状態の帰属を図に併記しましたので,照らし合わせてみてください。
![[Mn(II)(OH2)6]2+の吸収スペクトル](https://ik.imagekit.io/tfukuda/tr:w-0.5/coordchem/abs_Mn_II__OH2_6_PyXQ3MaBi.png?ik-sdk-version=javascript-1.4.3&updatedAt=1656943314610)
$\ce{[Mn^{II}(OH2)6]^{2+}}$ の吸収スペクトル

