ルイス酸の例
多くの遷移金属イオンは,配位子と配位結合を形成して金属錯体となりますが,これは金属イオンが配位子から電子対を受け取る酸塩基反応ですので,遷移金属イオンの多くはルイス酸であると言えます。また,典型元素の化合物にもルイス酸としてはたらくものが多くあります。本節ではルイス酸としてはたらく典型元素化合物を中心に紹介します。
13 族元素
ホウ素 $\ce{B}$ は 13 族元素で,価電子を三つ持ちます。したがって,ホウ素のハロゲン化物というのはハロゲンを $\ce{X}$ で書いたとすると $\ce{BX3}$ で表される化合物になるのですが,このとき,ホウ素まわりの電子数は全部で 6 個(電子対は 3 組)になりますので,$\ce{BX3}$ はオクテット則を満たさない化合物です。逆に言うと,$\ce{BX3}$ がオクテット則を満たすためには,電子対が一つ足りないということになり,電子対を受け入れることで安定なオクテット則を満たす構造になることができます。すなわち,$\ce{BX3}$ は電子対を欲しがっているルイス酸です。例として $\ce{BX3}$ とアミンの反応を見てみましょう。
アミンはアンモニアの水素の代わりに炭素が結合している化合物の総称で,いくつ炭素に置き換わっているかで級が決まりますが,いずれの場合でも非共有電子対を一つもちますので,ルイス塩基としてはたらきます。上の例ではメチル基が三つついたトリメチルアミンという 3 級アミンがハロゲン化ホウ素 $\ce{BX3}$ と反応して複合体が生成しています。
$\ce{BX3}$ の $\ce{X}$ には各種ハロゲン元素が入ることができて,$\ce{BF3}$,$\ce{BCl3}$,$\ce{BBr3}$ あたりが有機化学反応でルイス酸試薬としてよく用いられます。この三つの化合物のうち,どれが一番強いルイス酸としてはたらくでしょうか。フッ素の電気陰性度が一番大きいので,ホウ素が最も電子不足となって電子対を受け入れやすいのは $\ce{BF3}$ であると考えたくなりますが,実は反対で,生成物である $\ce{X3B\!:\!N(CH3)3}$ の熱力学的安定性は $\ce{BF3} < \ce{BCl3} < \ce{BBr3}$ となっています。これはハロゲン $\ce{X}$ とホウ素 $\ce{B}$ の空の $\ao{2p}$ 軌道が $\pi$ 結合を形成するためで,サイズの小さい $\ce{F}$ はより強く $\ce{B}$ と結合し,$\ce{BF3}$ の平面構造を安定化することで反応性が低下しているものと考えられます。
アルミニウムも 13 族元素ですので,そのハロゲン化物はルイス酸になります。ここでは塩化アルミニウム $\ce{AlCl3}$ を用いた有名な有機化学反応である フリーデル・クラフツ反応(Friedel-Crafts reaction)を紹介します。以下に示す反応は,クロロエタンとベンゼンからエチルベンゼンを合成するフリーデル・クラフツ反応の典型例で,この反応にはルイス酸(ここでは $\ce{AlCl3}$)が必要です。この反応がどのようなメカニズムで起こっているのかを見てみましょう。
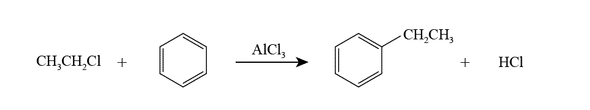
この反応は最初にクロロエタンの塩素原子と $\ce{AlCl3}$ の酸塩基反応から始まります。塩素原子は電子対を供与するルイス塩基,$\ce{AlCl3}$ はルイス酸です。下図では電子対の動きを細線の矢印で表しています。このステップで得られた複合体では,塩素原子上の電子が $\ce{AlCl3}$ 側に引っ張られますので,反対側の炭素原子は電子不足の状態 $\delta +$ になります。

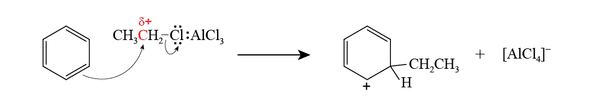
この電子が不足した炭素原子は,電子を求めて,ベンゼンに付加(求電子付加)して中間体を形成します。その過程で $\ce{C-Cl}$ 間の結合が切れ,$\ce{[AlCl4]-}$ として脱離します。
$\ce{[AlCl4]-}$ は中間体からプロトンを奪い,目的物であるエチルベンゼンとともに,$\ce{HCl}$ ならびに元の $\ce{AlCl3}$ が生成します。
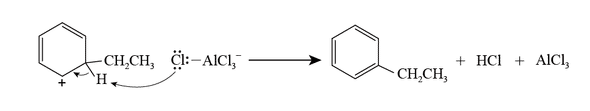
このメカニズムから分かるように,この反応において $\ce{AlCl3}$ は触媒としてはたらいています。ルイス酸触媒はさまざまな有機化学反応で活躍する酸塩基反応の重要な応用です。
14 族元素
14 族元素は「手」が 4 本でオクテット則を満たすので,ルイス酸にはならないのではないかと思うかもしれませんが,炭素を除く 14 族元素のハロゲン化物は超原子価状態をとりうるため,ルイス酸としてはたらきます。例として,四フッ化ケイ素 $\ce{SiF4}$ の反応を考えます。良く知られているように,フッ化水素 $\ce{HF}$(あるいはその水溶液であるフッ化水素酸)はガラスの主成分である二酸化ケイ素 $\ce{SiO2}$ を侵します。
$\ce{SiF4}$ は過剰のフッ化物イオンの存在下で超原子価状態となり,六フッ化ケイ素 $\ce{[SiF6]^{2-}}$ となります。
この反応は $\ce{SiF4}$ が ルイス酸,フッ化物イオンが ルイス塩基としてはたらく酸塩基反応です。ケイ素のハロゲン化物 $\ce{SiX4}$ のルイス酸としての強さは,電気陰性度から予想される通り $\ce{SiF4}$ が最も強く,$\ce{SiI4}$ が最も弱くなります。
15 族元素
14 族元素と同様に,窒素を除く 15 族元素のハロゲン化物も超原子価状態をとりうるため,ルイス酸としてはたらきます。特に五フッ化リン $\ce{PF5}$ や五フッ化アンチモン $\ce{SbF5}$ は有名な例です。$\ce{SbF5}$ については後のセクションで超酸(superacid)について学ぶ際に再登場します。
16 族元素
16 族元素化合物の例として三酸化硫黄 $\ce{SO3}$ を紹介します。$\ce{SO3}$ は強いルイス酸で,水と反応して硫酸となります。
この反応は水がルイス塩基としてはたらく酸塩基反応です。しかし,この反応は極めて大きな発熱を伴うため,硫酸の工業的な製造法としては用いられていません。工業的には $\ce{SO3}$ と濃硫酸から発煙硫酸(oleum)$\ce{H2S2O7}$ をはじめに合成し,これを希硫酸で希釈することで発煙硫酸を加水分解して硫酸を得ます。この硫酸の製造方法は接触法(contact process)として高校の化学でも習うものです。接触法はルイスの定義による酸塩基反応を利用した工業プロセスであると言えます。

