ブレンステッド酸の種類
ブレンステッド酸はプロトンを与える能力がある物質ですが,その構造によっていくつかのタイプに分類することができます。
アクア酸
酸性プロトン,すなわち解離するプロトンが配位した水分子に由来するブレンステッド酸をアクア酸(aqua acid)といいます。要は水和した金属イオンのことです。金属イオンに水分子が配位する反応自体はルイスの定義による酸塩基反応ですが,その結果生じたアクア配位子は,通常の水分子と比べて金属イオンに電子を引っ張られているため,プロトンが解離しやすくなっています。
アクア酸の $\pKa{}$ は,金属の種類や価数によって変化し,中心金属イオンの電荷(酸化数)が大きく,サイズが小さくなるほど $\pKa{}$ が小さくなる(酸性が強くなる)傾向があります。これは金属イオンがアクア配位子の電子をより強く引っ張るためです。極端な例は,クロム酸イオン $\ce{CrO4^2-}$ や過マンガン酸イオン $\ce{MnO4-}$ で,これらのイオンは,$\ce{Cr^6+}$ イオンや $\ce{Mn^7+}$ イオンの電荷が大きすぎて,アクア錯体 $\ce{[Cr(OH2)4]^6+}$ や $\ce{[Mn(OH2)4]^7+}$ が安定に存在できず,全部のプロトンが解離した結果生じたものとみなすことができます。
共有結合性が高い $\ce{Cu^2+}$ や $\ce{Sn^2+}$ などのアクアイオンも,金属イオンの正電荷が共有結合によってアクア配位子にまで広がるため,プロトンが解離しやすくなり,$\pKa{}$が小さくなる傾向があります。また,高周期元素ほど $\ao{d}$ 軌道とアクア配位子の酸素の軌道との重なりが大きくなるため,$\pKa{}$ が小さくなります。
アクア酸の $\pKa{}$ の大小関係を示す一例をあげます。
電荷が小さく,イオン性の高い $\ce{Na+}$ のアクア酸は $\pKa{}$ が大きく,電荷が大きい $\ce{Sc^3+}$ では $\pKa{}$ が小さくなります。$\ce{Mn^2+}$ と $\ce{Ni^2+}$ の比較では,後者の共有結合性が高いため $\pKa{}$ が小さくなると考えられます。
ヒドロキソ酸
酸性プロトンがオキソ $\ce{=O}$ を持たない原子に結合した水酸基に由来するブレンステッド酸をヒドロキソ酸(hydroxoacid)といいます。ヒドロキソ酸の例は単純な化合物ではあまり多くはなく,水酸化ナトリウム $\ce{NaOH}$ のように $\ce{OH-}$ で電離するものは含まれませんので,ヒドロキソ酸となるのは中心原子(イオン)と酸素原子との間の共有結合性が高い化合物に限られます。例として $\ce{Te(OH)6}$ などがあります。アクア酸で説明したクロム酸イオン $\ce{CrO4^2-}$ も,仮に $\ce{[Cr(OH2)4]^6+}$ から第一段階として,各アクア配位子からプロトンが一つずつとれて $\ce{[Cr(OH)4]^{2+}}$ となれば,この化学種はヒドロキソ酸とみなすことができますが,実際はこれを取り出すことは困難です。
オキソ酸
酸性プロトンがオキソ $\ce{=O}$ を持つ原子に結合した水酸基に由来するブレンステッド酸をオキソ酸(oxoacid)といいます。先ほどのヒドロキソ酸との違いは $\ce{=O}$ の存在ですが,この影響は極めて大きく,$\ce{=O}$ は電子を強く引っ張るので,オキソ酸の $\pKa{}$ は小さいもの(強い酸)が多いです。代表例として硫酸 $\ce{H2SO4}$ とその類似化合物を以下に示します。硫酸は硫黄原子がオキソを 2 個持つオキソ酸で強酸です($\pKa{1}=-1.9$)。ここにさらに電子を強く引っ張るフッ素を導入したフルオロ硫酸,さらにトリフルオロメチル基を導入したトリフルオロメタンスルホン酸はプロトンを与える能力がとても強く,有機化学反応で用いられます。一方,オキソの一つを硫黄で置換したチオ硫酸 $\ce{H2S2O3}$ は硫酸ほどの強い酸ではありません。
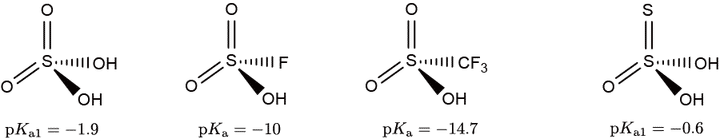
硫酸および関連物質の構造と $\pKa{}$
オキソの個数と $\pKa{}$ の関係は,次の塩素のオキソ酸を見るとよくわかります。左から過塩素酸(perchloric acid),塩素酸(chloric acid),亜塩素酸(chlorous acid),次亜塩素酸(hypochlorous acid)となっており,オキソの数が一つずつ減っています。$\pKa{}$ の変化は明らかで,過塩素酸と塩素酸でも 9 桁の違いがあり,最後の次亜塩素酸はもはやオキソを持たないのでオキソ酸ではありませんが,$\pKa{} = 7.5$ と弱い酸です。
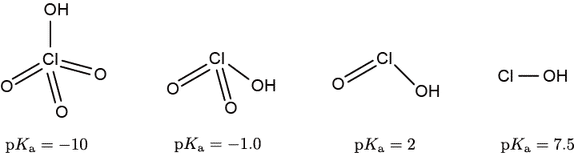
塩素のオキソ酸
炭酸 $\ce{H2CO3}$,硝酸 $\ce{HNO3}$,硫酸 $\ce{H2SO4}$,リン酸 $\ce{H3PO4}$,過塩素酸 $\ce{HClO4}$ などのよく見る酸の多くがオキソ酸です。

