プールベ図
ラチマー図,フロスト図と酸化還元を表す方法を学んできました。何を知りたいかの目的に応じて適した作図法があることが理解できたと思います。本節で扱うプールベ図(Pourbaix diagram)も酸化還元に関わる情報を表示する方法の一つです。プールベ図は横軸を $\pH$,縦軸を電極電位とした図として表され,どのような条件でどのような化学種が安定に存在できるかをまとめたものです。軸に由来して,$E-\pH$ 図と呼ばれることもあります。横軸が $\pH$ であることからも分かる通り,水中での化学種の挙動を対象としており,例えば環境の条件に応じて化学種がどのように変化するかといった環境化学における利用や,金属材料の腐食条件などの工学的な利用が考えられます。提唱者の Pourbaix 自身が Atlas of electrochemical equilibria in aqueous solutions というプールベ図全集のようなものを編纂しており,以下に示す図はそこから引用した鉄のプールベ図です。
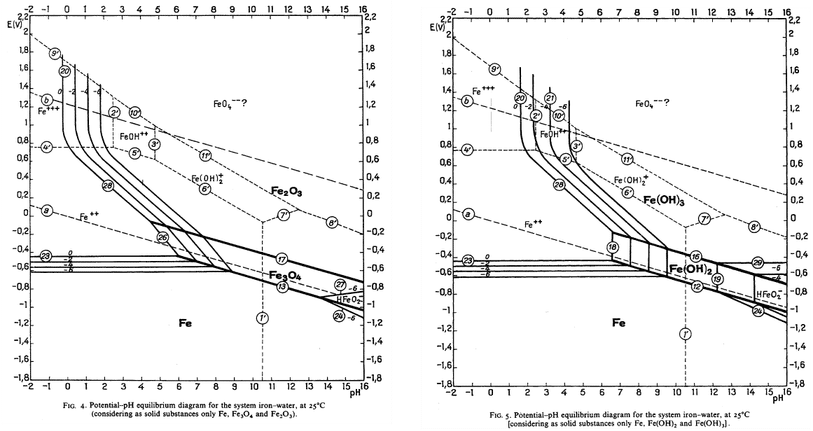
鉄のプールベ図
プールベ図を作図する際にどのような化学種が存在するかを前提として設定する必要がありますが,左の図は固体成分として $\ce{Fe}$,$\ce{Fe3O4}$,$\ce{Fe2O3}$ の存在を仮定したものであり,右の図は $\ce{Fe}$,$\ce{Fe(OH)2}$,$\ce{Fe(OH)3}$ の存在を仮定したものです。実線は二つの化学種が平衡状態にあるときの電位を $\pH$ に対してプロットしたもので,どのような酸化還元反応に関してのプロットであるかは〇付きの番号に対応させて(ここでは省略していますが)Atlas に記載されています。複数の細い実線が平行に引かれている箇所がありますが,これは溶存化学種の濃度(活量)の違いで引いてあるもので,例えば添え字 $-6$ の線は濃度 $10^{-6}\molL$ を意味します。どの線を使うかは用途によって異なり,例えば濃い溶液であれば $0$,希薄溶液であれば $-2$,そして溶液中に対象となるイオンがほとんど存在していない場合は $-6$ を使うといった具合です。ただし,Atlas の図はかなり詳細な情報まで含んでいますので,学習目的ではこれを簡略化したものを用いることが多いと思います。具体的には下図で赤で上書きしたようにエリア分けされたプールベ図を教科書などではよく目にします。青の破線で囲まれた部分は前に学習した水の安定領域です。
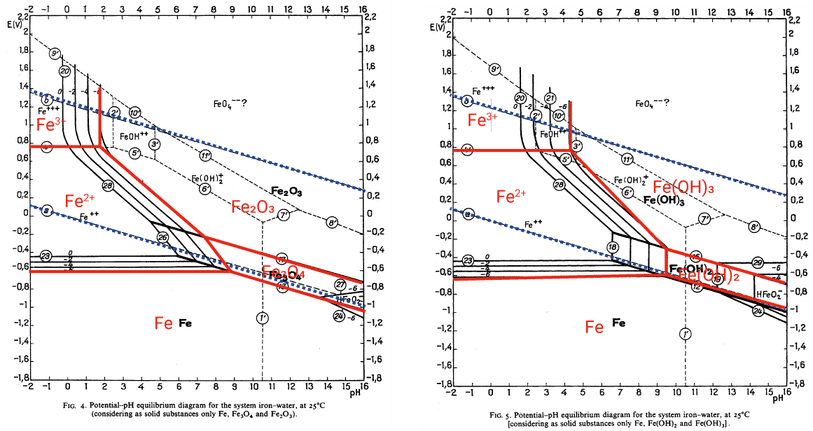
ここでは簡略版の左の図を使ってプールベ図の基礎的な見方を説明します。最初に図の下部にある $\ce{Fe}$ とラベルされた領域ですが,単体の鉄と共存する化学種の電極電位がこの領域にあるときは,鉄は酸化されずに安定に存在することができます。一方,$\ce{Fe^{2+}}$ や $\ce{Fe^{3+}}$ とラベルされた領域(共存化学種の電極電位が大きい = 還元されやすい = 酸化剤としてはたらく)では,鉄は酸化された状態が安定となり,水中に溶けだします。$\ce{Fe2O3}$ や $\ce{Fe3O4}$ の領域では鉄は酸化されますが,溶解度の低い固体として析出した状態が安定です。すなわち,環境に応じて鉄がどのような化学形態で存在するのが熱力学的に安定であるのかをこの図から読み取ることができます。右の図は酸化物の代わりに水酸化物として析出した場合を示していますが,基本的な考え方は同じです。上で「共存する化学種の電極電位がこの領域にあるときは」と述べましたが,実は水自体が共存する化学種であることを忘れてはいけません。図より酸性条件において,$\ce{Fe}$ と $\ce{Fe^{2+}}$ の境界線は常に水の安定領域より下にあることが分かります。したがって,上では「鉄は酸化されずに安定に存在する」と述べましたが,実際には水が共存して水が酸化剤としてはたらくので,鉄を酸性水溶液に入れると鉄は酸化され,水(プロトン)は還元されて水素が発生しますし,天然水のように溶存酸素が豊富な条件では鉄は 3 価の $\ce{Fe2O3}$ にまで酸化されます。
下図は銅(左)と亜鉛(右)のプールベ図です。この図から銅を塩酸のような酸化力のない酸に浸しても銅は酸化されず,水素ガスも発生しないが,亜鉛は水素ガスを発生して酸に溶解することが読み取れます。
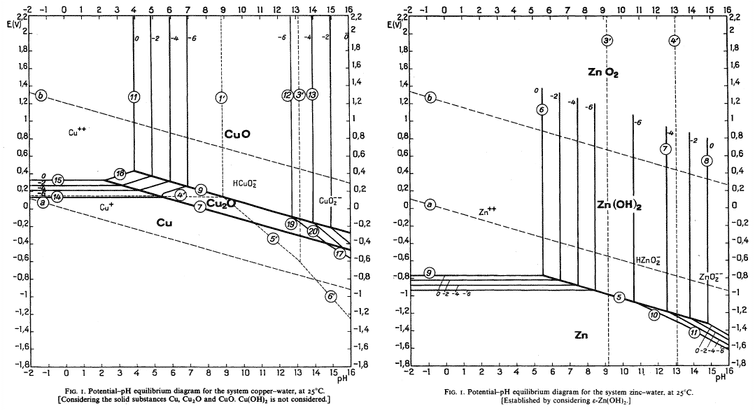
銅と亜鉛のプールベ図

