フロスト図
前節でラチマー図について学びましたので次はフロスト図(Frost diagram)を紹介します。フロスト図というのは,ある元素について横軸に酸化数,縦軸に各化学種の $\nue\Eo$ を累積的に加えた値をプロットしたグラフです。累積的と言うのは酸化数がゼロの単体を基準(ゼロ)として $\nue\Eo$ を積み上げていくということです。フロスト図では標準電極電位そのものをプロットしているわけではない点に注意してください。実例を見た方が早いと思いますが,ラチマー図からフロスト図を書き起こしてみると意味するところが捉えやすいので,ここではクロム $\ce{Cr}$ を例にラチマー図からフロスト図を作成してみます。$\ce{Cr}$ のラチマー図は以下の通りです。6 価は $\ce{Cr(VI)}$ と書いてもよいですが,この条件では通常二クロム酸イオンとして存在しますので具体的に $\ce{Cr2O7^{2-}}$ と書いています。
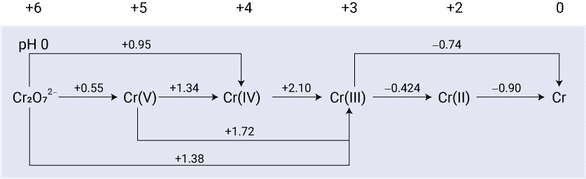
クロムのラチマー図
クロムの最大酸化数は $+6$ ですので横軸はゼロから $+6$ までとり,最初に単体 0 価のときの縦軸をゼロでプロットします。ラチマー図で言えば一番右の状態ですので,ラチマー図とフロスト図では左右が逆転します。ラチマー図を見ると酸化数 $+2$ から $0$ への標準電極電位は $-0.90\unit{V}$ とあります。これは 2 電子還元ですので $\nue\Eo = 2\times(-0.90) = -1.8\unit{V}$ をフロスト図の酸化数 $+2$ の箇所にプロットします。$\Eo$ ではなくて $\nue\Eo$ をプロットするのがミソで,横軸が 1 刻みの酸化数なので,酸化数変化 = 電子数と考えると,直線の傾きが $\Eo$ に一致します。

右下がりの直線が得られました。$\DGo{}=-\nue F \Eo$ の関係を思い出すと,電極電位が負ということは,逆反応である単体クロムから 2 価クロムへの酸化が進むとギブズエネルギーが小さくなることを意味しており,これはフロスト図上では右に向かって坂を下ることに相当します。次の酸化数 $+3$ から $+2$ への電極電位も負なので,これを今の $-1.8\unit{V}$ に累積すると $-2.224\unit{V}$ にプロットが描かれます。そして,次の酸化数 $+4$ から $+3$ の過程は $\Eo$ が正になりますので,いままで下ってきた線が右上がりに転じます。
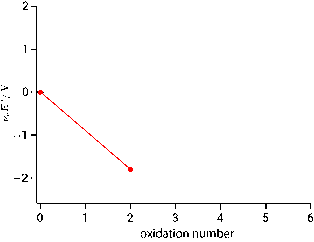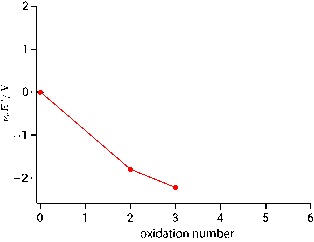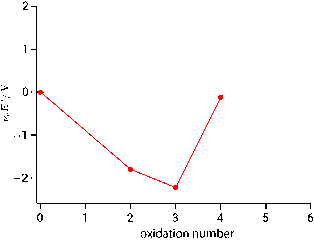
電極電位が正なのでクロム 4 価から 3 価の過程はギブズエネルギーが小さくなります。これはフロスト図上では $+4$ から $+3$ に変化,すなわち右から左に坂を下ることに相当します。このようにフロスト図では常に坂を下る方向がギブズエネルギー変化が負になる方向です。後は同じですのでフロスト図を完成させます。
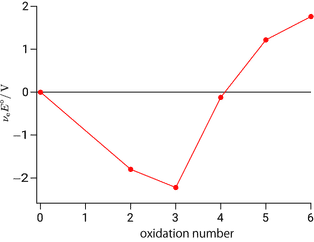
完成した図からクロムは 3 価が最も安定であり,6 価は 3 価に還元されやすい(酸化剤としてはたらく)ことが読み取れます。傾きが正に大きいほど強い酸化剤,小さい(負に大きい)ほど強い還元剤です。既に脚注にも書きましたが,酸化還元反応が進行するかどうかは実際には相手次第です。どのような条件のときに反応が進行するのでしょうか。フロスト図では直線の傾きが $\Eo$ ですので,二つの化学種を比較したときに傾きが大きい方が酸化剤,小さいほうが還元剤となります。具体的には次のようなイメージとなります。
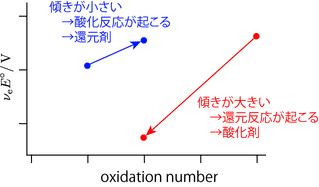
この図では便宜上酸化剤と還元剤を一つのフロスト図にまとめて描いています。酸化還元に関わる赤と青で示された二種類の化学種があるとき,この組合せでは傾きが急な赤色が酸化剤で青色が還元剤としてはたらきます。
フロスト図と不均化
二つの化学種の酸化還元挙動をフロスト図上で比較するとき,傾きが大きい方が酸化剤,小さい方が還元剤としてはたらくことを学びました。一方,化学種が一つであっても自らが酸化剤と還元剤の両方の役割をもつ場合がありました。既に学んだ不均化反応です。フロスト図を見ると不均化する化学種を簡単に見分けることができます。以下は先ほど示した $\ce{Cr}$ のフロスト図ですが,$\ce{Cr(V)}$ に注目します。6 価から 5 価への $\Eo$(直線の傾き)と 5 価から 4 価への $\Eo$ を比較すると,後者の傾きの方が大きいことが分かります。したがって $\ce{Cr(V)}$ は酸化剤として $\ce{Cr(V)}$ を酸化して自らは $\ce{Cr(IV)}$ に還元されると言うこともできますし,あるいは $\ce{Cr(V)}$ は還元剤として $\ce{Cr(V)}$ を還元して自らは $\ce{Cr(VI)}$ に酸化されると言うこともでき,いずれにせよ $\ce{Cr(V)}$ は不均化することが分かります。この傾きの大小関係が満たされるとき,フロスト図上では両サイドを結んだ直線に対して不均化する化学種は上に凸の位置関係になります。今は両隣を見ましたが,複数の酸化状態を間に挟んでも同じで,例えば $\ce{Cr(III)}$ と $\ce{Cr(VI)}$ を直線で結ぶと,間に挟まれた $\ce{Cr(IV)}$ と $\ce{Cr(V)}$ は直線の上に飛び出します。したがってこれらの酸化状態をもつ化学種は最終的に 3 価と 6 価に不均化すると考えられ,これが酸化クロム $\ce{Cr2O3}$ や二クロム酸カリウム $\ce{K2Cr2O7}$ のように 3 価と 6 価のクロム化合物が一般的である理由になっています。
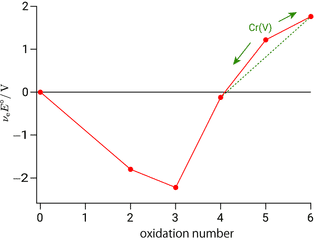
$\ce{Cr(V)}$ の不均化
上に凸で不均化すると学びましたので,既に学習済みの $\ce{Cu(I)}$ の不均化について,フロスト図で確認してみます。以下が銅のフロスト図で,たしかに $\ce{Cu(I)}$ が上に凸の関係にあることが確認できます。
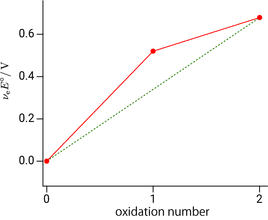
銅のフロスト図
フロスト図と均化
一つの化学種が自発的に二つ以上に分かれてしまうのが不均化であるのに対し,複数の化学種が最終的に一つに収束する現象は均化と呼ばれることを学習しました。均化の場合のフロスト図の特徴を見ます。以下は再びクロムのフロスト図ですが着目する箇所が違って,2 価から 4 価を見ます。先ほどの上に凸に対して,今回は下に凸になっています。溶液中に $\ce{Cr(II)}$ と $\ce{Cr(IV)}$ が存在するとしたとき,傾きが大きい $\ce{Cr(IV)}$ が酸化剤としてはたらき,他方の $\ce{Cr(II)}$ が還元剤としてはたらきますので,結果としてどちらの化学種も $\ce{Cr(III)}$ に落ち着きます。したがって均化が起こる熱力学的な条件は,フロスト図上において下に凸になることです。

$\ce{Cr}$ の均化