水の影響
本節では酸化還元反応における水の影響を考えます。多くの酸化還元反応は水溶液中で起こりますが,実は水自体も酸化剤や還元剤としてはたらきます。分かりやすい例はナトリウムと水から水素が発生する反応でしょう。
この反応でナトリウムは酸化されていますので,水は酸化剤としてはたらいたことになります。このとき水は還元されて(酸素が取れて)水素 $\ce{H2}$ となります。水の還元に関する半反応式は次のように書けます。
しかし式(\ref{h2ooxdnt})は,水が $\ce{H+}$ と $\ce{OH-}$ からなると考えると,反応前後で $\ce{OH-}$ は変化していませんので,酸化還元の観点からは次式(\ref{watoxislo})と等価です。すなわち水の還元とはプロトンの還元に他なりません。
プロトンの標準電極電位は定義によりゼロですので,式(\ref{watoxislo})の電極電位は前節の結果より $\pH$ に依存して次式(\ref{h2ooxeph})で表されることが分かります。
式(\ref{h2ooxeph})の値よりも小さい電極電位を持つ化学種は水を還元することができます(水により酸化されます)。$\pH$ が大きくなるにつれて水は還元されにくくなり $\pH\,14$ では $E = -0.826\unit{V}$ となります。上の例で示したナトリウムは $\Eo(\ce{Na+},\ce{Na}) = -2.71\unit{V}$ ですので $\pH$ に関わらず水を還元することが分かります。
水が還元剤としてはたらいた場合は,水は酸化されて(水素が取れて)酸素が生じます。半反応は酸素の還元反応として書きます。
式(\ref{watredslo})の値よりも大きい電極電位をもつ化学種は水を酸化することができます(水により還元されます)。水の酸化であっても還元であっても,電極電位は $\pH$ に対して同じ傾きの応答を示すことがわかります。
水の安定領域
水を酸化する又は還元する物質は(水と反応してしまうので)水中で安定に存在できません。安定に存在できる条件は電極電位が式(\ref{watoxislo})と式(\ref{watredslo})で定められた電位に挟まれた領域にあるときとなり,これを水の安定領域といいます。自然界の大抵の場所に水は存在しますので,自然界で物質が安定に存在するにはその物質の電極電位が水の安定領域内にある必要があります。一部の特殊な場所を除けば,湖沼などの天然水は $\pH$ の範囲がおよそ $4$ から $9$ ですので,環境中で安定に存在できる化学種が満たすべき電極電位の領域は下図の $E-\pH$ 図(Pourbaix 図)で示された領域となります。
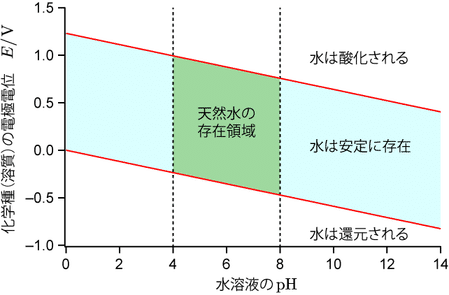
水の安定領域