高スピンと低スピン
前節までで,配位子の存在により,もともと縮退していた $\ao{d}$ 軌道が分裂する様子を示しました。その際,$\ao{d}$ 軌道には電子が既に入っていて,その電子の負電荷と配位子がもつ負電荷との静電反発が分裂の要因であると考えました。ここでは立場を少し変えて,まだ電子は一つも入っていないが,既に分裂している $\ao{d}$ 軌道を先に用意し,その軌道に電子を収めることを考えます。六配位正八面体型錯体を考えると,$\ao{d}$ 電子が 1 個のとき,その電子は(基底状態では)$\irrep{t}{2g}$ 軌道に収まります。この錯体が $\irrep{t}{2g}$ 軌道と $\irrep{e}{g}$ 軌道のエネルギー差に相当するエネルギーを吸収すると,$\irrep{t}{2g}$ 軌道の電子は $\irrep{e}{g}$ 軌道へと遷移して励起状態となります。これを $\irrep{e}{g}\leftarrow \irrep{t}{2g}$ と表記します。例えば,$\ce{[Ti(OH2)6]^{3+}}$ は $3\ao{d}^1$ 錯体ですので,可能な励起状態はただ一つの $\ao{d}$ 電子が $\irrep{t}{2g}$ 軌道に入った状態から $\irrep{e}{g}$ 軌道に入った状態へと遷移することに相当します。この錯イオンの吸収スペクトルを測定すると,波長 $493\unit{nm}$ 付近(波数では約 $20,300\unit{\wn}$)に一つの吸収帯が観測されます。これより,$\ce{[Ti(OH2)6]^{3+}}$ の $10Dq=\Delta_\mathrm{O}$ は約 $20,300\unit{\wn}$ であることがわかります。
![[Ti(OH2)6]の吸収スペクトル](https://ik.imagekit.io/tfukuda/tr:w-0.6/coordchem/abs_Ti_OH2_6_lWj8nuhvG.png?ik-sdk-version=javascript-1.4.3&updatedAt=1656943315175)
$\ce{[Ti(OH2)6]}$ の吸収スペクトル
電子の配置方法
$\grp{O}{h}$ 対称結晶場で分裂した $\ao{d}$ 軌道に電子を配置する場合,電子数が 3 個の場合($\ao{d}^3$)まではフント則に従って,エネルギーの低い $\irrep{t}{2g}$ 軌道にスピンを揃えて電子を配置すればよいです。この場合,電子の配置によって,電子一つあたり $4Dq$($0.4\Delta_\mathrm{O}$)だけエネルギーが安定化します。これを結晶場安定化エネルギー(crystal field stabilization energy, CFSE),あるいは分子軌道法の概念を基にするのであれば,配位子場安定化エネルギー(ligand field stabilization energy, LFSE)といいます。CFSE と LFSE は元となる考え方が異なるので本来別物ですが,電子が配置されることで得られる安定化エネルギーという概念は共通ですので,細かく使い分けずにどちらかで代表させる場合も多いです。ここでは以下,LFSE で統一することにします。例えば,$\ao{d}^3$ の LFSE は $-12Dq$($-1.2\Delta_\mathrm{O}$)となります。
さらに電子が一つ増えて $\ao{d}^4$ となった際の電子配置には二つの選択肢が存在します。一つはスピンを反転させて $\irrep{t}{2g}$ 軌道に電子を追加する方法で,この場合,一つの $\ao{d}$ 軌道に電子が二つ入るため,電子間の反発によるエネルギーの増加 $P$ が追加されます。すなわち,この場合の LFSE は $-16Dq+P$($-1.6\Delta_\mathrm{O}+P$)となります。二つ目の選択肢は,空の $\irrep{e}{g}$ 軌道にスピンを揃えて配置する方法で,この場合の LFSE は $-12Dq+6Dq=-6Dq$($-0.6\Delta_\mathrm{O}$)となります。前者を低スピン状態(low spin state,LS),後者を高スピン状態(high spin state, HS)といいます。
低スピンと高スピンのどちらの状態がよりエネルギー的に安定であるかは両者の LFSE の大小関係に依存します。$\ao{d}^4$ の場合,$-16Dq+P>-6Dq$,すなわち $P>10Dq$($P>\Delta_\mathrm{O}$)のとき,高スピンが選ばれます。これは考えてみると当たり前で,高スピンになるために必要な $10Dq$ よりも電子間の反発が小さければ,わざわざ高スピンになるエネルギー的なメリットがありません。よって高スピンは $10Dq$ が小さいとき,すなわち配位子場が弱い(weak field)ときに生じやすいと言えます。低スピンと高スピンの選択が可能であるのは $\ao{d}^4$ から $\ao{d}^7$ の電子配置であって,$\ao{d}^8$ 以降は再び一意に電子配置が定まります。高スピンの場合はペアを作る電子の数が自由イオンの場合と同じであるので $P$ による補正を考える必要はありません。
例えば,低スピン $\ao{d}^6$ の LFSE は $-4 \times 6 Dq + 2P = -24Dq + 2P$($-2.4\Delta_\mathrm{O} + 2P$)となります。自由イオンの状態で1つのペアがあるため,$3P$ ではなく $2P$ 分だけ不安定化する勘定になります。
$4\ao{d}$ 遷移金属錯体では,配位子場分裂エネルギーが大きく $P$ が小さいため,一般に低スピンとなります。高スピンと低スピンの電子配置の様式を以下に図示します。
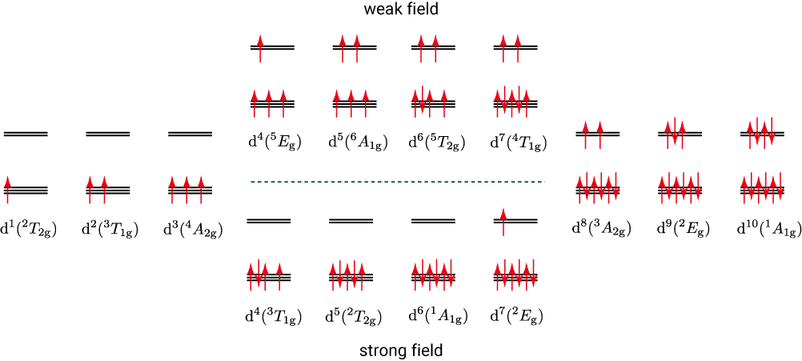
$\grp{O}{h}$ 配位子場における基底状態
T-4 か SP-4 か
同じ四配位錯体であっても,正四面体型の構造 T-4 をとるものもあれば,平面四角形型の構造 SP-4 をとるものもあるということを前節で学びました。例えば $\ce{[NiCl4]^{2-}}$ は T-4 をとりますが,一方で $\ce{[PdCl4]^{2-}}$ は SP-4 になります。一般に T-4 は高スピンの電子配置をとりますが,SP-4 は $\ao{d}_{x^2-y^2}$ 軌道が不安定化するため,低スピンとなりやすいといった特徴があります。$\ce{Ni(II)}$ と $\ce{Pd(II)}$ はどちらも $\ao{d}^8$ の電子配置ですが,SP-4 の低スピンでは,T-4 の高スピンと比べて電子間反発 $P$ が大きくなります。また,立体化学的には T-4 の方が空いており,SP-4 構造は立体反発エネルギー $S$ の分だけ不利になります。したがって SP-4 構造をとることにより得られる配位子場分裂による安定化エネルギー $\Delta E$ が,$S+P$ よりも小さければ T-4,大きければ SP-4 構造をとると考えることができます。
$\ce{Pd}$ は $4\ao{d}$ 金属であり,配位場分裂が大きいことから大きな $\Delta E$ が期待でき,$\ao{d}$ 軌道のサイズが大きいことから,$\ao{d}$ 電子間の反発 $P$ は小さくなります。また,イオン半径が大きいので,配位子間の立体反発 $S$ は小さくなることが予想されます。したがって $\Delta E > S + P$ の条件が満たされ,SP-4 構造をとるものと考えられます。一方,$\ce{Ni}$ は $3\ao{d}$ 金属で,$\Delta E$ がさほど大きくなく,かつ $S$ と $P$ が大きくなるため,T-4 構造になるものと考えられます。