超酸・超塩基
超酸(superacid)というのは,名前からして強力な酸なんだろうなということは予想できると思いますが,超酸(超強酸と呼ぶこともあります)のきちんとした定義は以下で与えられます。
超酸は $100\unit{\%}$ 硫酸よりもプロトンを与える能力が高い酸である。
また,超塩基(superbase)というものもあって,こちらは以下で約束されます。
超塩基は $\ce{OH-}$ よりもプロトンを受け取る能力が高い塩基である。
超酸
超酸の定義は上に示した通りですが,では具体的にどのような物質が超酸になるのでしょうか。典型的には,強力なルイス酸を強力なブレンステッド酸に溶かすことで超酸が得られます。強力なものと強力なものを混ぜて超強力なものにするというのは,若干安直すぎる発想にも感じますが,実際それで上手くいくのです。具体例を見ながら,超酸になるメカニズムについて考えてみましょう。ここでは強力なルイス酸として五フッ化アンチモン $\ce{SbF5}$,強力なブレンステッド酸としてフッ化水素 $\ce{HF}$ を考えます。これらの混合により,以下の反応が起こります。
これだけだと,どうして超酸が生じるのかわかりにくいので,反応を二つにわけて順に見ていきましょう。最初は $\ce{HF}$ の自己解離です。2 分子の $\ce{HF}$ が自己解離して共役酸の $\ce{H2F+}$ と共役塩基の $\ce{F-}$ が生じます。
共役酸 $\ce{H2F+}$ のプロトンを与える能力をさらに高めるにはどうすればよいか。共役塩基のプロトンを受け取る能力を弱めてあげることで,相対的に $\ce{H2F+}$ が他者にプロトンを与える能力が高まります。その役割をするのがルイス酸 $\ce{SbF5}$ です。
$\ce{SbF5}$ は強力なルイス酸ですので,生じる $\ce{SbF6-}$ は極めて弱い塩基となります。したがって,$\ce{H2F+}$ はもはやプロトンを奪う邪魔者がいなくなり,持てる限りのパワーでプロトンを与えることができる酸,すなわち超酸となるわけです。ここで紹介した物質はフルオロアンチモン酸(fluoroantimonic acid)と呼ばれることもあり,現状知られている中では最も強力な酸として分類されています。
最も強力な酸はフルオロアンチモン酸ですが,歴史的には 五フッ化アンチモン $\ce{SbF5}$ とフルオロ硫酸 $\ce{HSO3F}$ の組合せからなる超酸も有名です。
この物質はオラー(George Olah)によって開発されたもので,炭化水素である蝋(ろう)をも溶かす酸ということからマジック酸(magic acid)という名称が与えられています。オラーはマジック酸を用いた炭素のカチオン(カルボカチオン)の研究によって 1994 年にノーベル化学賞を受賞しています。
超塩基
超酸は一般家庭はもとより,化学実験室であっても特殊な場所でない限りなかなかお目にかかる機会はないかもしれません。一方,超塩基は意外と身近に存在する物質で,その代表格は酸化カルシウム $\ce{CaO}$(生石灰)でしょう。生石灰は乾燥剤として食品などに用いられており,おせんべいの袋に入っているのを見たことがある方もいると思います。乾燥剤にも種類がいくつかありますが,おせんべいの袋を開けてしばらく経ったもので乾燥剤の袋が膨れていたら $\ce{CaO}$ です。また,$\ce{CaO}$ は水と反応して発熱しますので,これを利用してお弁当をホカホカに温める利用もあります。
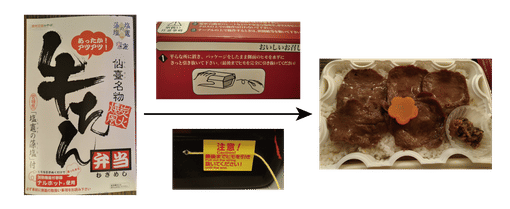
こういった,ひもを引っ張ると蒸気が出てきてホカホカのお弁当が楽しめる商品,知りませんか?中身を確認してみましょう。開けないでくださいと書かれていますが,注意して開けてみます。

写真には写っていませんが,水が入った袋が中に入っていて,ひもを引くと袋が破れて生石灰と水が反応して発熱する仕組みです。写真は使用後なので中身は生石灰ではなく水酸化カルシウム $\ce{Ca(OH)2}$(消石灰)になっています。
他にも超塩基の例はあって,水素化ナトリウム $\ce{NaH}$ や水素化カルシウム $\ce{CaH2}$ などは化学実験室でもしばしば用いられる代表的な超塩基です。$\ce{CaH2}$ も生石灰と同様に乾燥剤ですが,身の回りで用いられることはなく,もっぱら実験室での使用に限られます。その理由は,脱水能力は高いですが値段が高いことに加え,水と反応して水素を発生するためです。家庭で水素が発生するのは困りますが,実験室ではこの性質を逆に利用して,簡易に水素ガスを発生させる方法としても利用されます。